Շատ եմ մենակությունից ինձ հետ խոսում, և տխուր վիճակում և ուրախ։ Գրեթե ամեն օր է այդպես, երբ օրը վերջանում է ես ինձ հետ խոսում եմ, վատ բաները փորձում եմ մոռանալ լավերը հիշել։ Եղել է որ այնքան եմ մենակության մեջ խոսել ինձ հետ սկսել եմ լացել։ Ինքս իմ հետ խոսալը ինձ շատ օգնում է, ես հանգստանում եմ դրանից, պատկերացնում եմ թե խոսում եմ ինչ որ մեկի հետ և կիսվում իմ զգացողությունների, հիասթաությունների, ուրախությունների մասին։
Day: May 17, 2022
Թեմա `Իոնային կապ
Տեսություն
Քիմիական կապի առաջացման հիմնական շարժիչ ուժն ատոմի՝ 8 էլեկտրոն պարունակող արտաքին էներգիական մակարդակ ունենալու ձգտումն է:
Քննարկենք, թե ինչպես կարող է քիմիական կապ առաջանալ էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող ատոմների միջև, օրինակ` նատրիումի (Na) և ֆտորի(F):
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
Na0−e−→Na+
Ֆտորի ատոմն արտաքին էլեկտրոնային շերտում յոթ էլեկտրոն ունի, և կայուն վիճակի համար ֆտորի ատոմին ընդամենը մեկ էլեկտրոն է պակասում, ուստիև ավարտուն արտաքին էներգիական մակարդակ ստանալու համար շատ ավելի հեշտ է այդ ատոմին մեկ էլեկտրոն միացնել: Այդ մեկ էլեկտրոնը նատրիումի ատոմից վերցնելիս ֆտորի ատոմը փոխարկվում է 8 էլեկտրոն պարունակող, կայուն արտաքին շերտով, բացասական լիցքավորված մասնիկի այսինքն, ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
F0+e−→F−
Դրական (Na+) և բացասական F− մասնիկների միջև էլեկտրաստատիկական ձգողության ուժեր են ծագում, և որպես արդյունք՝ առաջանում է նատրիումի ֆտորիդ նյութը:
Advertisementsabout:blankREPORT THIS AD
Իոնները լիցքավորված մասնիկներ են, որոնք առաջանում են չեզոք ատոմներին էլեկտրոն միանալիս կամ էլեկտրոն տրամադրելիս:
Իոնի ձեռք բերած էլեկտրական լիցքն անվանվում է իոնի լիցք:
Իոնի լիցքը նշելիս նրա թվային արժեքը գրվում է «+» կամ «−» նշանով, ընդ որում՝ միալիցք իոնների դեպքում 1 թիվը չի գրվում:
Այն քիմիական կապը, որն առաջանում է իոնների միջև գործող էլեկտրաստատիկական փոխազդեցության շնորհիվ անվանվում է իոնային:
Էլեկտրաստատիկական ուժերի ծագման հետևանքով ձևավորվում է այսպես կոչված իոնային բյուրեղավանդակը:
Իոնային բյուրեղավանդակ առաջացրած միացություններն էլ անվանվում են իոնային միացություններ:
Օրինակ
NaF,NaCl,MgBr2,CaCl2
Իոնային կապ են առաջացնում նաև բարդ իոնները՝ լիցքավորված բազմատոմ մասնիկները, օրինակ՝(NH4),+(SO4),2−(OH),−(NO3)− և այլն:
Դրանք նույնպես իոնային կապով են միանում տարանուն լիցքով ոններին՝ (NH4)+Br−+,(SO4)2−+Ca2+,K++(OH)− և այլն:
Այս դեպքում բյուրեղավանդակի հանգույցներում կանոնավոր դասավորվում են պարզ և բարդ իոնները:
Իոնային կապը հագեցած չէ:
Իոնային կապն ուղղորդված չէ:
Սրանք են իոնային կապի գլխավոր հատկությունները: Այս կապի ուղղորդված չլինելը բացատրվում է այն հանգամանքով, որ լիցքի գնդաձև էլեկտրաստատիկական դաշտն իոնի շուրջը բոլոր ուղղություններով համաչափ է, և տարանուն լիցքով իոնը կարող է տարբեր կողմերից ձգվել, ընդ որում՝ կարող են տարբեր թվերով իոններ ձգվել: Այլ կերպ ասած՝ իոնային կապն առաջանում է ոչ թե տեղայնացված երկու մասնիկի, այլ մեծաթիվ մասնիկների միջև ու տարածական տարբեր ուղղություններով:
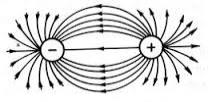
Իսկ տարբեր ուղղություններով գործող փոխազդեցության ուժերի գոյությունն ապացույց է, որ իոնային կապը հագեցած չէ: Այսպես, նատրիումի քլորիդի (NaCl) բյուրեղներում նատրիումի յուրաքանչյուր իոն (Na+) շրջապատված է քլորի 6 իոնով, քլորի յուրաքանչյուր իոն (Cl)՝ նատրիումի 6 իոնով:
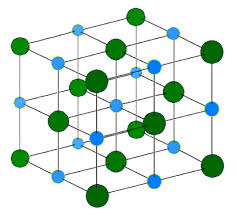
Իոնային միացությունների բյուրեղավանդակները կայուն են, ուստիև բնորոշվում են հալման ու եռման բարձր ջերմաստիճաններով:
Մայիսի 16-20
Թեմա` Կովալենտային կապ
Սովորել `էջ 132-138
Տեսություն
Փորձենք պատասխանել այն հարցին, թե ինչու և ինչպես է տեղի ունենում մոլեկուլի առաջացումը չեզոք ատոմներից: Ինչպե՞ս են առաջանում ոչ մետաղական պարզ նյութերի երկատոմ մոլեկուլները:
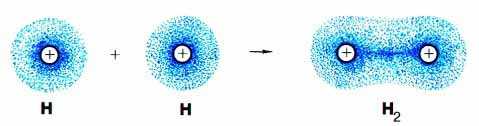
Դիտարկենք այդ հարցը ջրածին պարզ նյութի առաջացման օրինակով, որի մոլեկուլային բանաձևն է՝ H2: Ջրածնի ատոմում առկա է մեկ չզույգված էլեկտրոն՝ H⋅
Երկու ատոմներ միմյանց մոտենալիս առաջացնում են ընդհանուր էլեկտրոնային զույգ:
ՕրինակՋրածնի ատոմները միանում են մեկ ընդհանուր էլեկտրոնային զույգով՝ ըստ հետևյալ ուրվագրի՝
H⋅+⋅H→H:HՆոր առաջացած էլեկտրոնային զույգը, որն անվանվում է նաև ընդհանրացված, միաժամանակ և հավասարաչափ պատկանում է ջրածնի երկու ատոմին: Ընդհանուր էլեկտրոնային զույգը ձգվում է ջրածնի երկու ատոմների դրական լիցքավորված միջուկների կողմից, «ցեմենտում» դրանք՝ ապահովելով մոլեկուլի կայունությունը:
Քիմիական կապը, որն առաջանում է երկու ատոմի միջև ընդհանրացված էլեկտրոնային զույգի միջոցով կոչվում է կովալենտային:
Յուրաքանչյուր էլեկտրոնային զույգ մեկ քիմիական կապ է:
Ջրածնի մոլեկուլում առկա է մեկ ընդհանրացված էլեկտրոնային զույգ և հետևաբար՝ մեկ քիմիական կապ:
Ընդունված է էլեկտրոնային զույգը փոխարինել գծիկով և կստացվի ջրածնի մոլեկուլի գրաֆիկական բանաձևը (գծապատկեր-բանաձև)՝ H–H: Թթվածնի ատոմների միջև առաջանում է երկու ընդհանուր զույգ՝ երկու քիմիական կապ՝ O=O: Այդպիսի կապը կոչվում է կրկնակի կապ:
Ազոտի մոլեկուլում ընդհանուր էլեկտրոնային զույգերը երեքն են՝
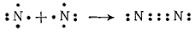
Ազոտի մոլեկուլում առկա է կովալենտային ոչ բևեռային եռակի կապ` N≡N
Այն կապը, որն առաջանում է հավասարաչափ բաշխված ընդհանրացված էլեկտրոնային զույգերով, որոնց կապված են երկու միջուկները (կենտրոնների) կոչվում է կովալենտային ոչ բևեռային:
Հաստատված է, որ ցանկացած քիմիական կապ առաջանում է ատոմների արտաքին էլեկտրոնային շերտի էլեկտրոնների մասնակցությամբ, և կապի բնույթը որոշվում է էլեկտրոնների շարժման օրինաչափություններով:
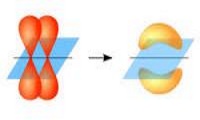
Որակական առումով մոլեկուլն ատոմների փոխազդեցության արդյունք է և ոչ ատոմների պարզ մեխանիկական հավաքածու:Մոլեկուլ առաջանալիս տեղի է ունենում էլեկտրոնային ամպերի վրածածկ:
Եթե էլեկտրոնային ամպերի վրածածկը տեղի է ունենում երկու ատոմների միջուկների միացման գծի ուղղությամբ (կապի առանցքով), ապա այդ կապն անվանում են սիգմա (σ) կապ: σ− կապը՝ միակի պարզ կապ է:
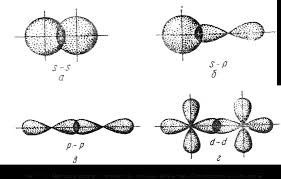
Եթե կապվող ատոմների միջև մեկից ավելի էլեկտրոնային զույգ է առաջացել, ապա կապն անվանվում է բազմակի՝ կրկնակի (երկու ընդհանուր զույգ) կամ եռակի (երեք ընդհանուր զույգ):
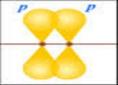
Բազմակի կապերից մեկն անպայման σ -կապ է, իսկ մյուսները՝ π -կապեր,
π -կապն առաջանում է ρ -էլեկտրոնային ամպերի կրկնակի, կողմնային վրածածկից՝ σ -կապի առանցքին ուղղահայաց:
Մայիսի 9-13
Թեմա `Քիմիական կապի բնույթը
Սովորել `էջ 128-138
Տեսություն
Քիմիական միացությունների մոլեկուլները որոշակի հաջորդականությամբ միմյանց կապված ատոմների համախումբ են:
Նյութերի քիմիական հատկությունները պայմանավորված են քիմիական կապերի տեսակով, կապ առաջացնող ատոմների բնույթով և մոլեկուլում դրանց փոխազդեցությամբ:
Հին ժամանակներից սկսած՝ գիտնականները փորձում են պարզել, թե ինչպես են կառուցված նյութերը, ինչպե՞ս և ինչու՞ են ատոմները միանում, և ի՞նչ ուժեր են նրանց իրար մոտ պահում:
XX դարում ֆիզիկոսները պարզեցին, որ ատոմները կապվում են էլեկտրական լիցք ունեցող մասնիկներով` արտաքին էներգիական մակարդակի էլեկտրոններով, որոնք ձգվում են կապվող ատոմների դրական միջուկների կողմից: Հետևաբար, ատոմները կապող ուժերը էլեկտրական բնույթի են:
Ատոմների կապը մեկը մյուսի հետ անվանում են քիմիական կապ:
Քիմիական կապը փոխազդեցություն է էլեկտրոնների և միջուկների միջև,
որը հանգեցնում է մոլեկուլում ատոմների միացմանը:
Քիմիական կապն ատոմների փոխազդեցություն է, որն ուղեկցվում է էներգիայի անջատումով:
Այդ էներգիան կազմում է 40-ից մինչև 1000կՋ/մոլ: Էներգիայի այդպիսի լայն միջակայք հնարավոր է տարբեր փոխազդեցությունների պատճառով, որոնք ներկայումս հիմնականում դասակարգվում են որպես կովալենտային,իոնային և մետաղային կապեր:
Կովալենտային կապ առաջանում է ոչ մետաղների ատոմների միջև:
Իոնային կապ առաջանում է մետաղների և ոչ մետաղների ատոմների միջև:
Մետաղական կապ առաջանում է մետաղական պարզ նյութերում և համաձուլվածքներում: